蚊子蛋白的发现可能导致治疗威胁生命的病毒
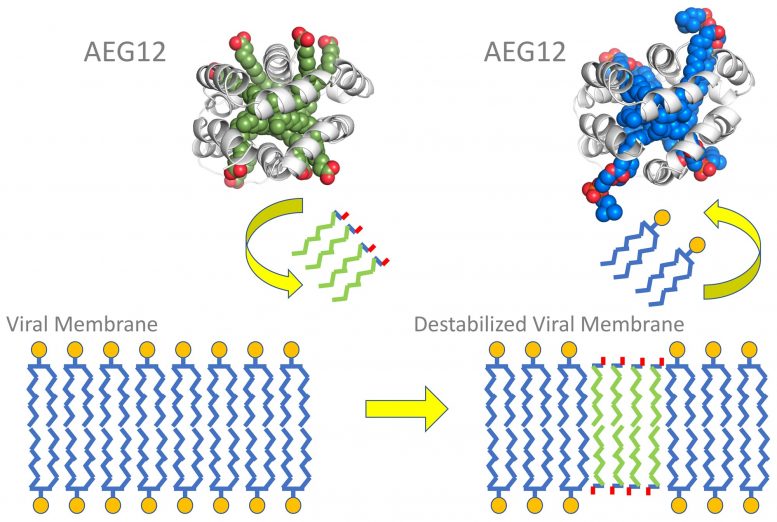
病毒膜脂质双层的插图显示了喜欢水的头部(黄色圆圈)和讨厌水的尾部(蓝色波浪线)。AEG12 基于蛋白质的晶体结构(绿色和灰色),将其一些脂质(绿色曲线)插入病毒膜,使其不稳定。在此交换过程中,AEG12 将病毒脂质整合到其内部(蓝色和灰色)。
根据美国国立卫生研究院 (NIH) 的科学家及其合作者的说法,蚊子蛋白 AEG12 可强烈抑制导致黄热病、登革热、西尼罗河和寨卡病毒的病毒家族,并弱抑制冠状病毒。研究人员发现,AEG12 的作用是破坏病毒包膜的稳定性,破坏其保护层。尽管这种蛋白质不会影响没有包膜的病毒,例如导致红眼病和膀胱感染的病毒,但这些发现可能会导致针对影响全球数百万人的病毒的治疗方法。该研究在线发表在 PNAS 上。
设备推荐: 金相显微镜
隶属于 NIH 的国家环境健康科学研究所 (NIEHS) 的科学家们使用 X 射线晶体学来解决 AEG12 的结构。资深作者、NIEHS 核磁共振小组负责人 Geoffrey Mueller 博士说,在分子水平上,AEG12 撕掉了脂质,或将病毒结合在一起的膜的脂肪样部分。
“就好像 AEG12 渴望病毒膜中的脂质,所以它会去除它拥有的一些脂质,并将它们换成它真正喜欢的脂质,”穆勒说。“这种蛋白质对病毒脂质具有很高的亲和力,可以从病毒中窃取它们。”
因此,穆勒说 AEG12 蛋白对某些病毒具有强大的杀伤力。虽然研究人员证明 AEG12 对黄病毒(寨卡病毒、西尼罗河病毒和其他病毒所属的病毒家族)最有效,但 AEG12 可能对导致COVID-19的冠状病毒SARS-CoV-2有效。但是,穆勒说,要使 AEG12 成为 COVID-19 的可行疗法,还需要多年的生物工程。部分问题是 AEG12 也会破坏开放的红细胞,因此研究人员将不得不确定仅使蛋白质靶向病毒的化合物。
NIEHS 访问学者和该论文的主要作者 Alexander Foo 博士解释说,蚊子在吸血或感染黄病毒时会产生 AEG12。与人类一样,蚊子会对这些病毒产生强烈的免疫反应,AEG12 会破坏它们的病毒覆盖物。但是,在项目开始时,Foo 和他的同事对 AEG12 的功能知之甚少。
“研究一种新蛋白质的前景令人兴奋,但也令人生畏,”Foo 说。“值得庆幸的是,我们有足够的线索并获得了 NIEHS 的广泛专业知识来拼凑起来。”
合著者和晶体学专家 Lars Pedersen 博士是 NIEHS 结构功能组的负责人。他经常在工作中使用有关分子物理构成的信息,并鼓励更多的科学家考虑在他们的研究中使用这些数据。他说:“我们的研究表明,了解蛋白质的结构对于弄清楚它的作用以及它如何帮助治疗疾病非常重要。”
